Dando continuidade nos estudos relacionados à Ciências dos Materiais, que começou no Scicast #545 e teve continuidade em outros textos (1, 2, e 3) aqui no Portal Deviante, abordaremos mais conceitos relacionados à estrutura de materiais.
Estamos familiarizados com a ideia de que materiais são compostos de átomos e que muito da sua classificação se dá pelo tipo de ligação química. Mas um átomo estar ligado com outro é capaz de explicar as propriedades desse material por si só? Será que os átomos de ferro ao se ligarem já fazem um lingote metálico com todas as suas características? Veremos, nesse texto, que temos mais elementos para essa discussão.
A estrutura dos sólidos cristalinos
Tijolos. Imaginem vários deles. Vamos assumir, para esse exemplo, que os tijolos são átomos e eles estão organizados de duas maneiras: jogados, na forma de um monte, e empilhados, na forma de uma coluna (Figura 1). Se analisarmos os tijolos jogados, podemos ter dificuldade em observar algum padrão, até mesmo porque provavelmente nem exista um (Figura 1 (a)). Já no caso dos tijolos empilhados, é possível observar uma estrutura padrão e, até mesmo uma unidade de repetição capaz de explicar toda a estrutura (Figura 1 (b)). Nesse exemplo, somos apresentados ao conceito de material cristalino, de estrutura cristalina e de célula cristalina.

Figura 1 — Tijolos! (a) Tijolos jogados, sem padrão de repetição, representando um material não cristalino. (b) Coluna de tijolos, com unidades de repetição definidas, capazes de descrever a coluna inteira, representando um material cristalino.
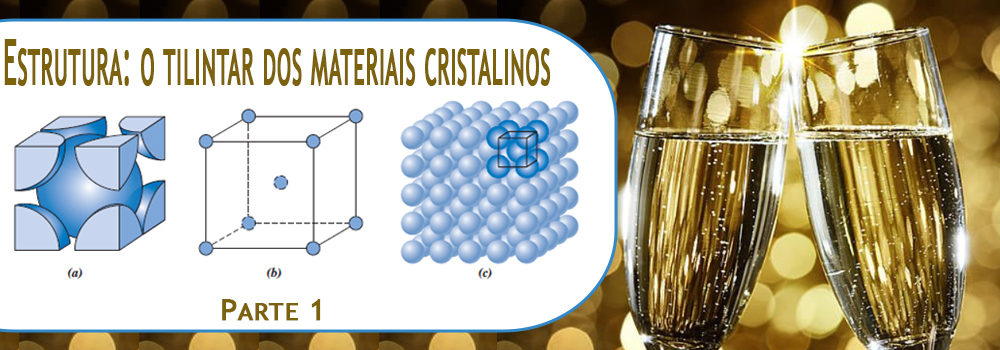
De forma mais técnica, nos sólidos, os átomos ou íons se organizam de diferentes formas. Se eles formam um padrão regular ao longo de grandes distâncias (sempre lembrando que estamos em escala atômica), chamamos isso de estrutura cristalina. É como se cada átomo encontrasse seu lugar em um arranjo tridimensional repetitivo, conectado aos seus vizinhos mais próximos (Figura 2). Os metais, muitos materiais cerâmicos e alguns polímeros se organizam assim quando solidificam.
Mas nem todos os sólidos seguem essa ordem. Alguns não têm essa organização regular e são chamados de amorfos. As propriedades dos sólidos cristalinos dependem de como esses átomos, íons ou moléculas estão dispostos. Existem muitas estruturas cristalinas diferentes, desde as simples, como nos metais, até as muito complexas, como em alguns materiais cerâmicos e poliméricos.
Essas estruturas cristalinas são compostas por pequenas unidades repetitivas chamadas células unitárias, que são como os blocos de construção da estrutura. Geralmente, essas células são paralelepípedos ou prismas com faces paralelas. Elas representam a simetria da estrutura cristalina e podem ser transladadas para gerar todas as posições dos átomos no cristal. Os vértices dessas células geralmente coincidem com os centros dos átomos. Embora existam várias células unitárias possíveis para uma estrutura cristalina, normalmente usamos aquela com a maior simetria geométrica.

Figura 2 — Para a estrutura cristalina cúbica de faces centradas, podem ser apresentadas: (a) uma representação da célula unitária usando esferas rígidas (nos vértices temos 1/8 de uma esfera e nas faces, 1/2), (b) uma célula unitária com esferas reduzidas e (c) um agrupamento de muitos átomos.
Sistemas cristalinos
Inúmeros são os estilos arquitetônicos que contemplam as edificações mundo a fora. Dessa forma, é obvio que temos colunas feitas de tijolos com estilos diferentes (mas que não deixam de ser uma coluna de tijolo). Para as estruturas cristalinas dos sólidos isso também é observado.
Como há muitas formas diferentes de estruturas cristalinas, às vezes é útil agrupá-las com base em como suas células unitárias são configuradas ou como os átomos estão arranjados dentro delas. Um desses grupos se concentra na forma da célula unitária, que é essencialmente o formato do bloco básico que representa a estrutura, independentemente de onde os átomos estão dentro dele.
Nesse contexto, estabelecemos um sistema de coordenadas XYZ com origem em um dos cantos da célula unitária. Cada eixo (X, Y e Z) segue uma das três arestas do bloco. A forma da célula unitária é descrita por seis parâmetros: os comprimentos das três arestas (a, b e c) e os três ângulos entre os eixos (α, β e γ), como mostrado na Figura 3. Esses parâmetros são chamados de parâmetros de rede de uma estrutura cristalina.

Figura 3 — Uma célula unitária exibindo os parâmetros de estrutura cristalina. Eixos coordenados x, y e z, indicando os comprimentos axiais (a, b e c) e os ângulos entre os eixos (α, β e γ).
Com base nesse princípio, existem sete combinações possíveis de a, b, c, α, β e γ, cada uma representando um sistema cristalino diferente: cúbico, tetragonal, hexagonal, ortorrômbico, romboédrico, monoclínico e triclínico. A Figura 4 mostra as relações para esses parâmetros e as representações das células unitárias para cada sistema.
O sistema cúbico, por exemplo, tem todas as arestas iguais e ângulos retos, o que lhe confere o maior grau de simetria. Já o sistema triclínico exibe a menor simetria, com arestas e ângulos todos diferentes.

Figura 4 — Relações entre os Parâmetros da Rede Cristalina e Figuras Mostrando as Geometrias das Células Unitárias para os Sete Sistemas Cristalinos
É importante notar que muitos dos conceitos discutidos aqui também se aplicam a materiais cerâmicos e poliméricos. No entanto, as estruturas cristalinas nesses materiais tendem a ser mais complexas do que aquelas em metais. Além disso, para esses materiais, estamos frequentemente interessados em determinar fatores como empacotamento atômico e densidade usando equações modificadas. Essas estruturas também se encaixam nos sete sistemas cristalinos com base na geometria da célula unitária.
Poliformismo e alotropia
Mesmos átomos, mas estruturas cristalinas e, consequentemente, materiais diferentes. Alguns metais e também alguns elementos não metálicos podem existir em mais de uma forma de estrutura cristalina, um fenômeno chamado polimorfismo. Quando isso acontece em elementos simples, é frequentemente chamado de alotropia. A estrutura cristalina mais comum depende tanto da temperatura quanto da pressão.
Um exemplo clássico disso é o carbono: a grafita é o tipo mais comum que vemos em lápis, mas o diamante é outra forma do carbono que só se forma sob pressões super altas. Outro exemplo é o ferro puro, que tem uma estrutura CCC em temperatura ambiente, mas muda para CFC quando aquecido a 912°C. Num futuro, trataremos do porquê de a temperatura ter esse efeito (termodinâmica, baby), mas essa mudança de CCC para CFC faz com que o material deixe de ser magnético, por exemplo. Assim, pode-se dizer que há essa mudança de estrutura, também há mudanças em propriedades como densidade e outras características físicas.

Figura 5 — Dois alótropos do carbono. (a) Diamante, com estrutura cúbica, e (b) grafite, com estrutura hexagonal.
Em materiais sólidos cristalinos, cada átomo está posicionado em um ponto específico dentro de uma estrutura cristalina. Unidade de repetições, as células unitárias, conseguem representar toda a estrutura e delas vem a classificação dos sistemas cristalinos, que podem ser de diferentes formas geométricas. Um mesmo conjunto de átomos podem se organizar em estruturas diferentes, o que dá origem a materiais com propriedades, processamento e desempenho bem diferentes, como o grafite e o diamante. Dessa forma, finalizamos a primeira parte dessa discussão. Teremos mais na segunda parte!
Fonte: Callister Jr, William D., and David G. Rethwisch. Callister’s materials science and engineering. John Wiley & Sons, 2020.