Como visto no episódio 545 do SciCast e no texto Materiais: como compreendê-los com ajuda de uma história de lutinha Parte 1 , os materiais são descritos por meio de quatro componentes que se relacionam entre si: estrutura, propriedades, processamento e desempenho. Com essas informações, podemos entender um material como um todo e ter uma maior compreensão de como utiliza-lo no nosso dia a dia.
Entretanto, é óbvio que cada um desses quatro componentes é um universo. De forma conceitual, naquela explicação mais generalizada, se atingiu uma maior compreensão de cada um deles, mas a ciências dos materiais ainda avança nesses campos. Por isso, vale a pena nos aprofundarmos um pouco em cada um dos quatro componentes para os entendermos de forma introdutória. No texto de hoje falaremos sobre estrutura!
Átomos
Falar da estrutura dos materiais é, no fundo, falar de átomos. Não poderia ser diferente, porque todo material é o resultado do conjunto de átomos que o compõe e de como esses átomos interagem entre si. Dessa forma, podemos dizer que átomos se revelam como intrincadas construções, com núcleos compostos por prótons e nêutrons, e elétrons orbitando ao redor.
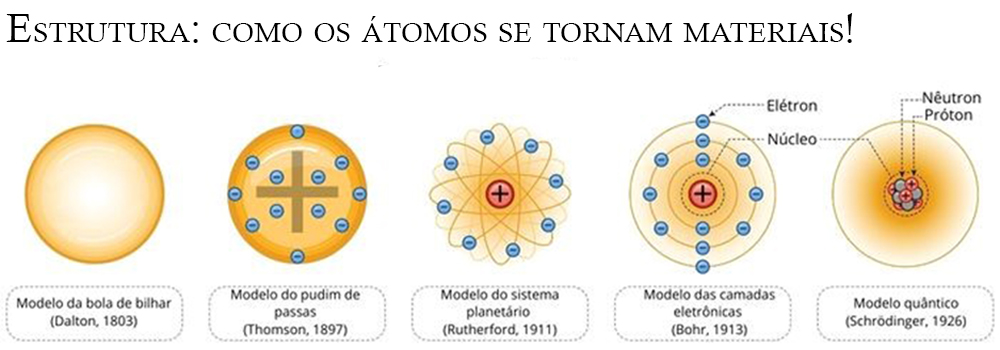
Com o avanço da física, tem se construído novos e mais precisos modelos de uma estrutura atômica. A Figura 1 apresenta os modelos atômicos que foram apresentados no decorrer dos anos. Nota-se uma clara evolução de algo maciço, do modelo de Dalton, a algo dividido em núcleo e elétrons, em que não se sabe certamente onde esse últimos estão.

Figura 1 — Os modelos atômicos, os quais evoluem do modelo de bola de bilhar de Dalton (1803), modelo de pudim de passas de Thomson (1897), modelo do sistema planetário de Rutherford (1911), modelo de camadas eletrônicas de Bohr (1913) e do modelo quântico de Schrödinger (1926). Fonte
É importante apontar esses diferente modelos e frisar que não necessariamente um é melhor que o outro. Quando estudamos a organização dos átomos em um material, o modelo mais utilizado é o de Dalton, visto que ele é capaz de trazer informações sobre a natureza do átomo (se é oxigênio ou urânio, por exemplo) e onde ele posiciona nessa estrutura. Obviamente, os outros modelos também são utilizados para explicar propriedades, processamentos e desempenhos dos materiais.
Com o amplo número de modelos atômicos, temos a vasta quantidade de elementos químicos compostos por esses átomos. Felizmente, é possível classificar os elementos químicos por características em comum. Uma das classificações mais clássicas é apresentada na forma de uma tabela periódica (Figura 2). Os elementos químicos podem ser divididos em metais, ametais e intermediário. Nota-se que, dentre todos, os metais são os mais numerosos, seguidos pelos ametais, que possuem características que se contrapõem aos metais, e por último os intermediários, que compartilham características dos outros dois tipos.

Figura 2 — Tabela periódica em que se apresentam os elementos químicos, como se classificam, seus números e pesos atômicos.
Um importante adendo nesse ponto: não é porque um elemento químico é metálico que ele necessariamente fará parte de um material classificado como metal. Aqui, embora se compartilhem nomes, existem classificações distintas. Uma é sobre elementos químicos, outra sobre materiais. Falaremos mais sobre isso no futuro.
Ligações interatômicas
Átomos isolados dificilmente são apreciados nas ciências dos materiais. No entanto, quando estão ligados com outros, a história muda de panorama. Ao pegarmos um material qualquer na mão, como um pedaço de vidro, sabemos que ali existe um número gigantesco de átomos que interagem e estão unidos de alguma forma.
As forças eletromagnéticas que mantêm os átomos unidos são regidas por energias de ligação. Essa energia é essencial, pois representa a resistência à separação de dois átomos previamente unidos. Notoriamente, a resistência à separação é variável entre cada tipo de átomo e sua interação com um outro átomo.
Dentro das ligações interatômicas primárias, destacam-se as covalentes, iônicas e metálicas. Nas ligações covalentes, átomos compartilham elétrons, formando moléculas estáveis. As ligações iônicas envolvem a transferência de elétrons, gerando íons com atração mútua. Já as ligações metálicas criam um “mar” de elétrons, conferindo propriedades únicas de condução elétrica e maleabilidade aos metais.
A Figura 3 mostra uma representação esquemática de uma ligação covalente. Podemos observar que os dois átomos de hidrogênio possuem um único átomo na camada de valência, quando dois são necessários para um equilíbrio químico. Dessa forma, há um “compartilhamento” de átomos, em que os dois átomos de hidrogênio, quando ligados, conseguem encontrar tal equilíbrio mesmo com apenas dois elétrons.

Figura 3 — Representação esquemática de uma ligação covalente de dois átomos de hidrogênio.
A Figura 4 apresenta uma representação esquemática de uma ligação iônica. Notamos que o átomo de sódio perde um elétron de sua camada de valência, enquanto o átomo de cloro o recebe. Nesse momento, ambos os átomos se tornam íons carregados com cargas opostas: íon de sódio é positivo e íon de cloro é negativo. Dessa forma, a tal “força que atrai os opostos” ligam os íons, o que forma assim uma molécula de cloreto de sódio (NaCl).
Por sua vez, na Figura 5 podemos ver uma representação esquemática da ligação metálica. Notamos que átomos dos elementos químicos classificados como metais conseguem compartilhar elétrons entre vários deles. Nesse caso, um mar de elétrons mantém uma força eletromagnética que os mantém ligados.

Figura 5 — Representação esquemática de uma ligação metálica entre átomos de elementos químicos classificados como metais, como o sódio.
O sódio, quando ligado com outros átomos de sódio por meio de ligações metálicas, é um material classificado como metal. Por isso, é um material sólido, maleável, que pega fogo ao ser jogado na água (isso realmente acontece). O cloro, por sua vez, quando ligado com outro cloro por meio de ligações covalentes, forma uma molécula de Cl2, um gás.
No entanto, quando um átomo de sódio e um átomo de cloro se ligam por meio de ligações iônicas, eles formam um composto branco, frágil, que some na água e deixa tudo salgado: o sal de cozinha, que é um material classificado como uma cerâmica. Nota-se que independentemente da classificação do elemento químico, quando ele se liga com algum outro, ele dá origem a uma terceira “entidade”, a um composto químico que tem suas próprias propriedades e pode pertencer a qualquer um dos tipos de materiais.
As ligações interatômicas secundárias, como as forças de Van der Waals e as pontes de hidrogênio influenciam as propriedades dos materiais. As forças de Van der Waals surgem de flutuações temporárias de carga, enquanto as pontes de hidrogênio envolvem atrações específicas entre átomos de hidrogênio e outros átomos eletronegativos. A grosso modo, se diz que são ligações mais fracas que as primárias, mas de sumária importância.
Diamante e grafite são materiais sólidos compostos unicamente por átomos de carbono. No entanto, todos os átomos de carbono nos diamantes estão ligados quimicamente por meio de ligações primárias covalentes, enquanto os átomos de carbono nos grafites estão parcialmente ligados por ligações primárias covalentes e ligações secundárias de van de Waals (Figura 6). É clara a diferença de propriedades entre os dois; grafite é um ótimo lubrificante sólido e diamante é excelente material de riscamento e corte.

Figura 6 — Esquematização das ligações químicas entre átomos de carbono no diamante e no grafite. Nota-se que para o diamante, todas as ligações são primárias por meio de linhas sólidas. Enquanto no grafite alterna entre linhas sólidas que ligam átomos de carbono em lamelas e linhas tracejada, ou seja, ligações secundárias, que ligam as lamelas entre si. Fonte
A correlação entre ligações interatômicas e materiais
Ao chegarmos até aqui, vimos muito sobre átomos e como eles se ligam entre si. Na primeira aula de ciências de materiais, me perguntei por que eu estava vendo conteúdo de química. Nada como avançar nos estudos para me fazer compreender.
A Figura 7 apresenta essa correlação entre ligações interatômicas e materiais em dois tetraedros. Nota-se que na Figura 7 (a), nos vértices, estão indicadas as ligações interatômicas puras e, nas arestas, as ligações interatômicas mistas. Já na Figura 7 (b) estão indicados os materiais que podem ser formados ao depender das ligações interatômicas. Nota-se que polímeros e metais são compostos ligados exclusivamente por ligações interatômicas covalentes e metálicas, respectivamente. Por sua vez, semimetais, semicondutores, intermetálicos e cerâmicas são compostos por ligações mistas que combinam dois tipos de ligações interatômicas.

Figura 7 — (a) Tetraedro de ligação: Cada um dos quatro tipos de ligação extremos (ou puros) está localizado em um vértice do tetraedro; três tipos de ligações mistas estão incluídos ao longo das arestas do tetraedro. (b) Tetraedro do tipo de material: correlação de cada classificação de material (metais, cerâmicas, polímeros etc.) com seu(s) tipo(s) de ligação.
Dessa forma, é possível ver uma correlação direta entre ligações interatômicas e materiais. A partir desse ponto, ainda dentro do componente estrutura, podemos avançar em como os átomos de cada compostos químicos e, consequentemente, de cada material se organizam. Para isso, no futuro, discutiremos a estrutura dos sólidos cristalinos (e amorfos, de quebra).
Fontes:
Callister Jr, William D., and David G. Rethwisch. Callister’s materials science and engineering. John Wiley & Sons, 2020.
Outras citadas no decorrer do texto.